药品销售榜大变样!政策促洗牌,企业如何守护大品种?

来源: 医药经济报
国内已上市大品种即将面临一致性评价、注射剂再评价、工艺核对等政策的影响。本文通过回顾分析2015年至2017年上半年的销售排名前二十品种的变化,跟踪目前各大品种展开一致性评价的进度,以观察和评估政策对大品种的影响,分析企业对策。
2017上半年排名变化:
辅助用药排名纷纷下跌
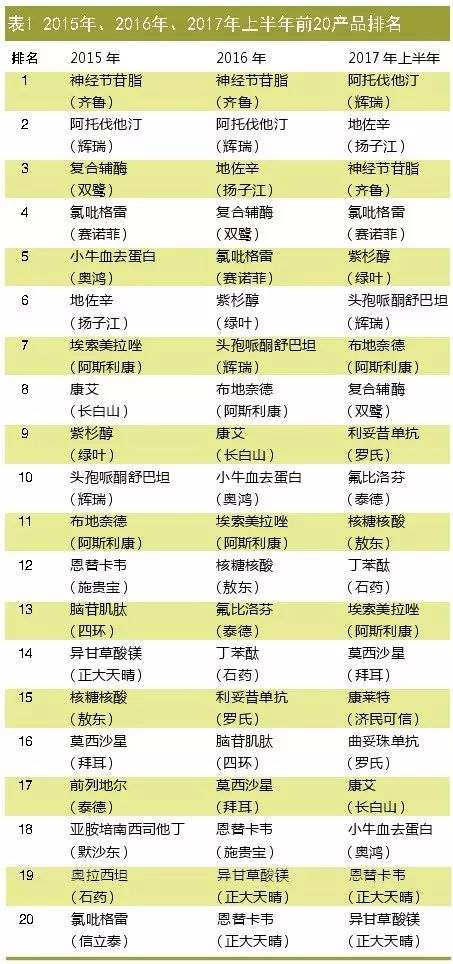
2017年上半年,2015年排名前五的产品中有3个排名和销售额都下跌。其中2015年和2016年都排名第一的齐鲁神经节苷脂跌落到第三的位置;2015年排名第三的双鹭复合辅酶在2016年下降到第4位,2017年下降到第8的位置;2015年排名第5的奥鸿小牛血去蛋白在2016年排名第10位,2017年则跌到第18的位置。
(数据来源:咸达数据 V3.2)
神经节苷脂、复合辅酶和小牛血去蛋白排名下降的原因,预计主要是受到2015年各省开始执行辅助用药目录和重点药品重点监控政策的影响。CFDA自 2015年起加强了生化药品质量监管,并对相关厂家进行飞检,亦波及个别生化药厂家。
2017年排名第一的是辉瑞的阿托伐他汀(Lipitor)。辉瑞阿托伐他汀自2011年11月在美国市场失去专利保护开始,美国销售业绩经历悬崖式下跌并失去全球第一的交椅,从2011年的95.77亿美元直接跳水至2012年的39.48亿美元,2013年继续萎缩至23.15亿美元。而国内市场情况则大不同,国内仿制药1999年就拿到批准文号了,但2017年仍不能撼动这个过期原研药的位置。
扬子江的地佐辛原研产品在国外已退市。扬子江地佐辛抓住了阿片类产品成瘾性的痛点进行推广,从2015年的第六位上升至2017年的第二位,成为镇痛药的老大。
对照全球市场的前三产品在我国市场的排名,在全球市场连续五年拿下最畅销药“冠军”的艾伯维阿达木单抗从未进入我国的前20名,类风湿关节炎和免疫系统用药在我国的市场表现就一般,这与我国的用药习惯和医保支付制度有一定的相关性。
2016年全球排名第二的吉利德复方索磷布韦/雷迪帕韦在我国尚未上市。2017年丙肝治疗用药在我国上市的有施贵宝的阿舒瑞韦胶囊和盐酸达拉他韦片,吉列德的索磷布韦也已获批。2018年将可以看到中国丙肝药品市场的全球新药争夺战。
全球排名第三的罗氏利妥昔单抗终于在2017年挤进全国用药前十。复星医药控股子公司复宏汉霖申报生产利妥昔单抗的生物类似药,在中信国健因临床自查而撤回上市申请后,这是最先报产的国内企业。
一致性评价开始受理:
产品保护战正式打响
对于现有在销的产品而言,影响较大的政策有一致性评价和注射剂再评价,此外还有工艺核对。
一致性评价政策自2015年年底开始提出企业是政策执行的关键主体,2016年公开289个2018年年底必须完成一致性评价的17,740个产品的清单。2017年8月公布企业开展289目录内仿制药质量和疗效一致性评价基本情况表,目录内的产品仅26%的企业开展了一致性评价。
2017年,CFDA发布《仿制药质量和疗效一致性评价受理审查指南(需一致性评价品种)》,确定了一致性评价接收号/受理号赋予原则,属于“报国家食品药品监督管理总局审批的补充申请事项:其他”。
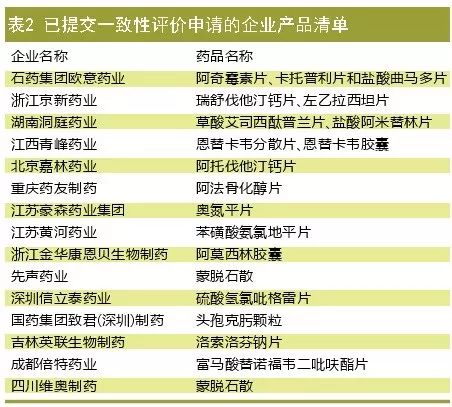
自2017年9月开始接受一致性评价的补充申请以来,截至2017年11月,CDE共承接了25个已有药品名称的受理号。如表2所示,石药集团欧意药业申报的产品通用名数最多,包括阿奇霉素片、卡托普利片和盐酸曲马多片。浙江京新药业、湖南洞庭药业和江西青峰药业以申报2个产品并列第二。
(数据来源:咸达数据 V3.2)
已申报的一致性评价产品中,属于289品种的有卡托普利片、阿莫西林胶囊、阿奇霉素片、苯磺酸氨氯地平片、蒙脱石散、盐酸阿米替林片、硫酸氢氯吡格雷片和阿法骨化醇片8个,仅占2.7%。11个产品通用名不在289目录以内,从侧面反映出企业以保住现金流产品目的开展一致性评价的动力更足。
表1所提到的销售额排名前二十的产品中,信立泰硫酸氢氯吡格雷片已发起品种保护战。江西青峰药业申报恩替卡韦分散片和恩替卡韦胶囊,北京嘉林药业申报阿托伐他汀钙片,则是为了抢夺市场。
过期原研药也通过地产化、作为仿制药的代加工方等方式降低生产成本并抢夺市场。例如美罗药业利用MAH制度与阿斯利康(中国)达成合作共识,美罗药业出资5000万元在中国医药城设立江苏美罗药业有限公司,从事包括“可定”(瑞舒伐他汀钙片)在内的共计4个品种仿制药的注册申报和仿制药一致性评价,并委托阿斯利康(中国)作为受托生产企业进行生产。“可定”仿制药的原辅料、包材以及生产线均与阿斯利康“可定”原研药一致,过一致性基本没问题,有意向布局瑞舒伐他汀钙片的国内厂家需要加快一致性评价进度。
小结<<<
2018年年底的最后通牒时间未到,已有15个厂家在已上市产品守护战的一致性评价小战役中抢占19个通用名的先机(见表2)。获得一致性评价的产品对市场的影响,预计最快也要2018年了。
对于辅助用药或有效性不明确的注射剂产品来说,尽早开展有效性、药物经济学相关的试验,通过临床数据证据来证明其在处方中的位置,争取进入指南和临床路径,方为保住市场最佳之道。