年终总结:2017年医疗健康产业政策概述(医药篇)

来源于火石创造
文|杨超
2017年10月,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称《意见》),在医药圈引起了不小的轰动。
该《意见》对审评审批制度改革做了系统的制度设计,核心是促进药品创新和仿制药发展,主要表现在三方面:一是加快上市审评审批;二是改革临床试验管理;三是加强药品医疗器械全生命周期管理。总体来讲,该《意见》具有满足公众用药需求、调整提升我国医药产业结构、推动药品供给侧结构性改革的重大意义。
其实,自2015年8月,国务院出台《关于改革药品医疗器械审评审批制度的意见》,药品医疗器械审评审批改革大幕正式拉开。两年来,一系列改革政策相继出台,药品和医疗器械在研发、注册、审评审批等各个方面都取得阶段性成效。
表1 2017年药品医疗器械审评审批改革相关政策

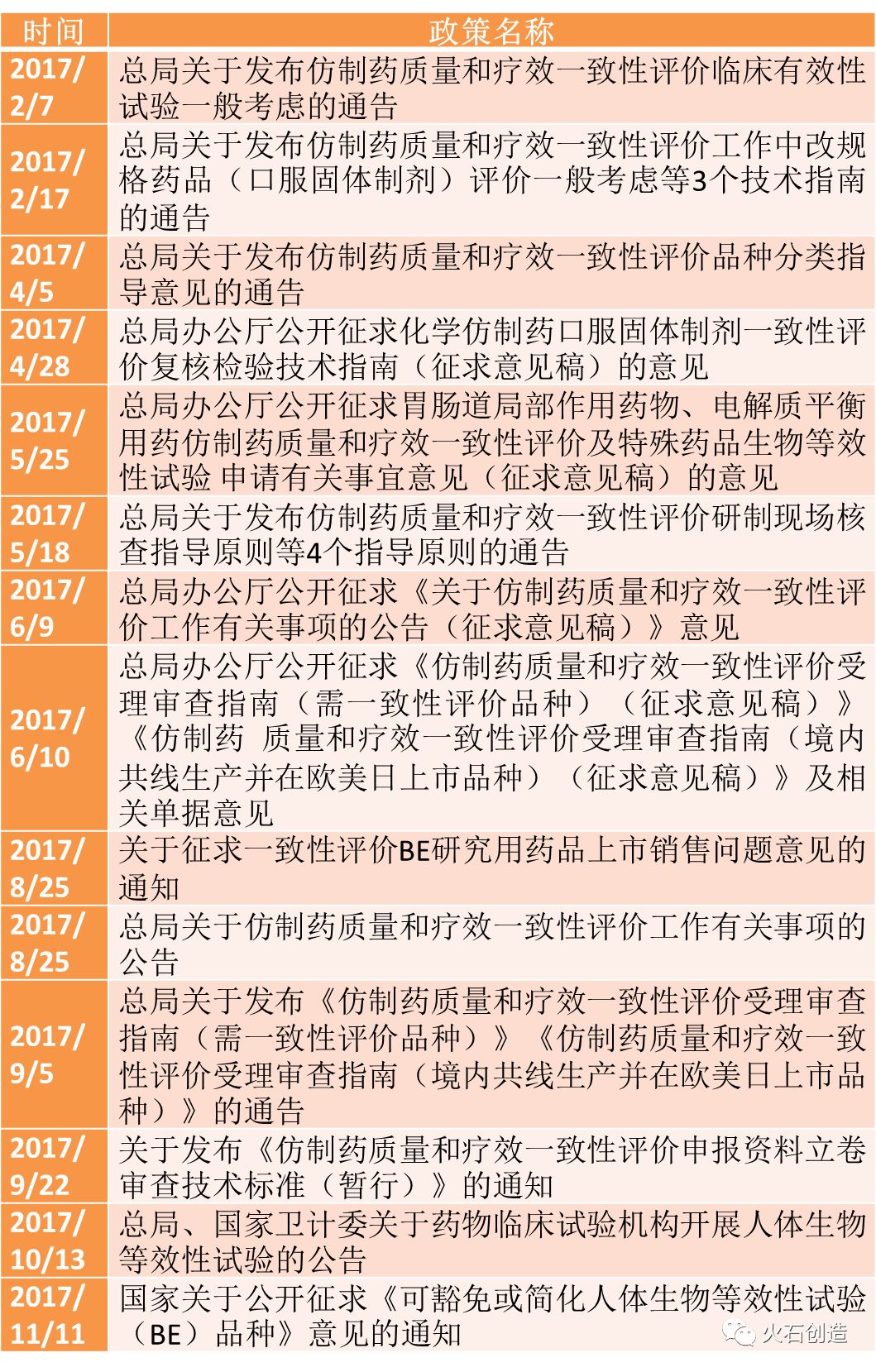
推动仿制药一致性评价同样是2017年我国医药行业改革的重点工作任务。自2016年3月,《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》发布,我国仿制药一致性评价工作就此正式拉开了序幕。
2017年相关政策主要还是针对一致性评价工作不同情况的指导性文件。其中有关参比制剂目录,以及涉及BE临床试验的两份相关名单最受业内的关注。
其中,参比制剂目录的发布意味着企业推进一致性评价的第一步有了相对确定的行动参照,为后期加速推进奠定了基础。自2016年3月起,CFDA共发布10批参比制剂,共计898个药品品规,其中有170条涉及2018年底要完成一致性评价工作的品种。
BE临床试验名单的发布为企业在一致性评价中的临床试验工作环节提供了便捷,有效促进相关工作的快速推进。2017年10月,CFDA公布619家可以进行等效性临床试验的机构名单。11月,CFDA公布可以豁免BE或简化BE的品种名单,共计56个。
表2 2017年仿制药一致性评价相关政策
在多项政策的推进下,仿制药一致性评价已经有一定进展。据《企业开展289目录内仿制药质量和疗效一致性评价基本情况表》,截至2017年5月,在289目录中,有17个品种开展评价的企业超过50家,复方磺胺甲 噁唑片、诺氟沙星胶囊、甲硝唑片的一致性评价竞争将最为激烈,开展评价的企业数量均超过100家。但也有110多个品种不那么“热门”,开展评价工作的企业均不超过3家。
上市许可持有人制度在2016年6月正式启动试点,2017年8月,CFDA发布相关文件,对持有人的权利义务和法律责任、相关监督职责划分等有关事项进行明确。此外,在《关于改革药品医疗器械审评审批制度的意见》中也要求推进上市许可持有人制度全面实施。
据有关机构统计,自启动试点以来,截至2017年10月,10个试点省市共受理试点药品品种各类申请560件,其中已完成审批128件,已受理和在审评审批的有428件。
2017年10月,《药品管理法》修订内容出台,将GMP、GSP相关内容正式删除,取消GMP认证的“传言”终于落实。但取消GMP认证,并不意味着GMP不再执行,这仍然是药品生产企业的基本要求,相关检查依然展开。

