“研发一哥”易主?半年研发投入近12亿,这家药企或斩获国内首个CAR-T

来源于米内网原创
日前,复星医药发布公告称,其投资公司复星凯特的CAR-T产品FKC876正式获得国家药监局临床试验批准,该产品有可能成为国内首款获批上市的CAR-T细胞药物。2018年上半年,复星医药研发投入11.88亿元赶超恒瑞,5个生物药处于临床III期,利妥昔单抗上市提交上市申请,获批在即;报告期内,公司3个重磅产品通过一致性评价,10个产品处于申请阶段,进展超越大部分药企。
图1:2015-2018年同期复星医药研发投入情况(单位:亿元)
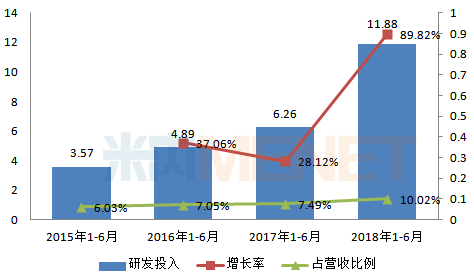
(来源:上市公司中报)
8月28日,复星医药发布2018年半年度报告,公司实现营业收入118.59亿元,同比去年同期增长41.97%,归母净利润15.61亿元,同比去年同期下降7.61%,归母净利润同比去年同期减少的其中一个主要原因就是创新研发和业务布局的投入上升所带来的影响。
报告期内,公司研发投入11.88亿元,同比去年同期增长89.82%,研发费用7.09亿元,同比去年同期增长53.69%。药品制造与研发业务板块是公司业绩的支撑点,也是公司研发投入的着重点,2018年上半年,公司药品制造与研发业务研发投入10.64亿元,同比去年同期增长100.9%,研发费用5.96亿元,同比去年同期增长63.29%。
国内首个CAR-T争夺战,复星医药后来者居上
CAR-T,即嵌合抗原受体T细胞免疫疗法,目前在白血病、淋巴瘤、黑色素瘤、脑胶质瘤等恶性肿瘤治疗中均显示出良好的抗肿瘤效应。诺华、Kite等企业在CAR-T产品的开发上处于领先地位,国内也顺势把握住了这一时代潮流,CAR-T产品研发在中国得以快速发展。
从目前国内药企CAR-T产品的研发进展看,西比曼、博生吉、合一康、南京传奇等走在前列,2015年以后,银河生物、科济生物、恒瑞医药等公司也大手笔布局CAR-T产品,均取得不同程度的进展。
表1:国内部分CAR-T产品研发进展
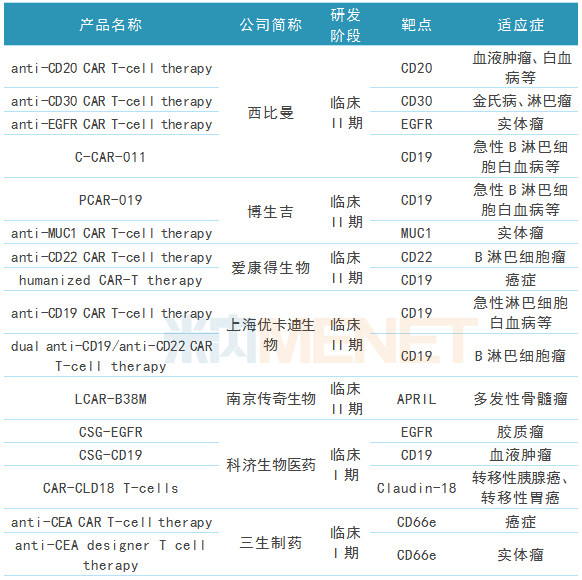
(来源:米内网全球药物研发库)
据米内网全球药物研发库数据,走在前列的西比曼的CBM-C30.1、CBM-C19.1、CBM-EGFR.1等CAR-T产品均已处于临床II期,博生吉的PCAR-019、anti-MUC1 CAR T-cell therapy、CAR-pNK等CAR-T产品也已处于临床II期;后起之秀的科济生物的CSG-EGFR、CSG-CD19等CAR-T产品均已处于临床I期。
由此可见,复星医药在CAR-T产品上的布局并不算早,但公司却借助与Kite Pharma合作而奋起直追。2017年初,公司与Kite Pharma合作成立合资公司-复星凯特,正式开始CAR-T产品的研发。2018年9月6日,复星医药发布公告称,复星凯特的CAR-T产品FKC876正式获得国家药监局临床试验批准。
FKC876,美国商品名Yescarta,于2017年10月18日获得美国FDA批准上市,是FDA批准的首款针对特定非霍奇金淋巴瘤的CAR-T细胞药物。2018年8月27日,Yescarta获得欧洲EMA批准上市,成为欧洲第一批上市的CAR-T细胞治疗产品,用于治疗复发或难治性弥漫大B细胞淋巴瘤(DLBCL)和原发纵膈大B细胞淋巴瘤(PMBCL)。
图2:FKC876审评时间轴
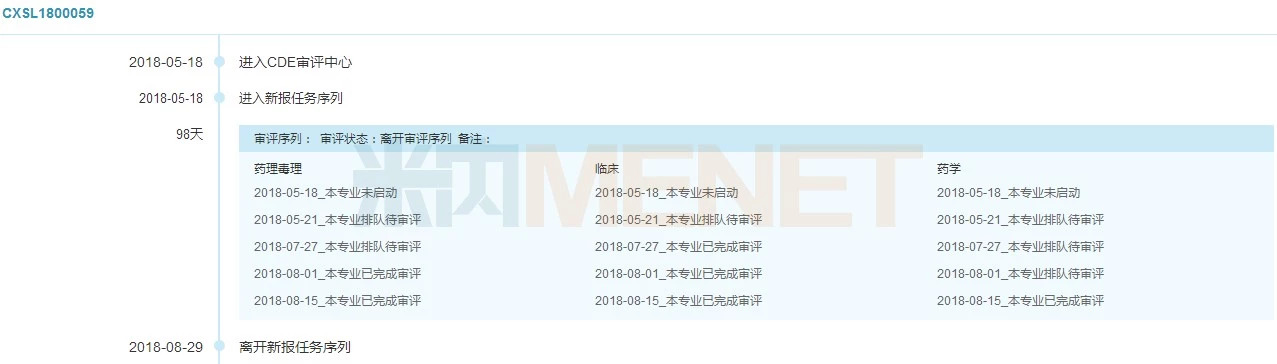
(点击图片可放大)
(来源:米内网MED中国药品审评数据库2.0)
据米内网MED中国药品审评数据库2.0数据,复星凯特FKC876治疗复发难治性大B细胞淋巴瘤的临床申请于2018年5月18日获得CDE受理承办,受理号为CXSL1800059,从CDE正式受理到完成技术审评只用了98天(不到70个工作日),由此可以看出国家在优化药品审评审批改革的工作方面力度卓有成效,同时也体现了CDE对公司申报材料质量的认可和肯定。
此前,国家药监局注册司副司长杨胜指出:“对于境外已上市的、防治严重危及生命且无有效治疗手段疾病以及罕见病的药品,同时经研究确认不存在人种差异的,申请人无需申报临床试验,可直接以境外试验数据申报上市,药品上市时间将加快1-2年。”复星凯特直接嫁接引入在美国、欧盟已通过临床试验、成熟上市的产品,如今临床试验获批,有望借助境外数据在国内快速推进临床试验,理论上只要证明不存在人种差异,复星凯特就可以直接以境外试验数据申报上市,在进度上实现弯道超车,或将“斩获”国内首个CAR-T产品。
据米内网全球药物研发库,除了kite的Yescarta,全球已上市的CAR-T产品还有诺华制药的tisagenlecleucel-T(商品名Kymriah),Kymriah与复星凯特的FKC876的靶点同为CD19,主要用于治疗儿童和年轻成人(2-25岁)的急性淋巴细胞白血病及成年人复发/难治性大B细胞淋巴瘤。
押宝单抗生物药,利妥昔单抗上市在即
据复星医药年报及中报数据,2017年全年公司研发投入15.29亿元,2018年上半年仅半年时间,研发投入就高达11.88亿元,直逼去年全年总研发投入。公司研发布局着重于单抗等生物创新药、生物类似药及小分子创新药等。
表2:复星医药及子公司部分在研产品
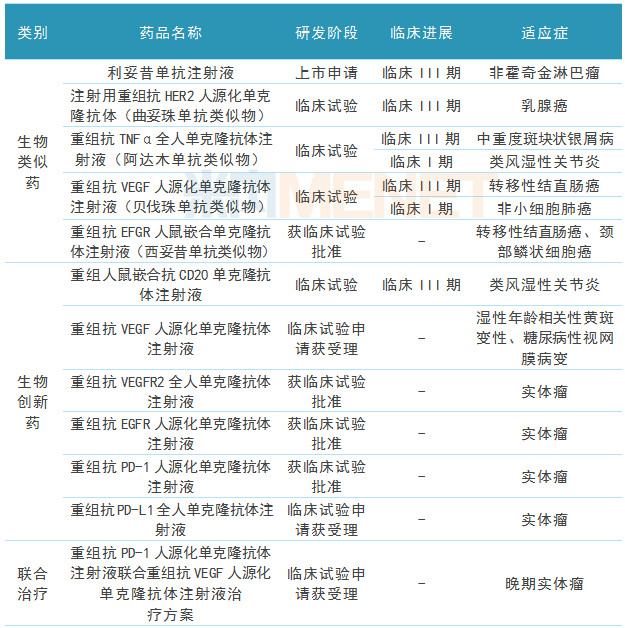
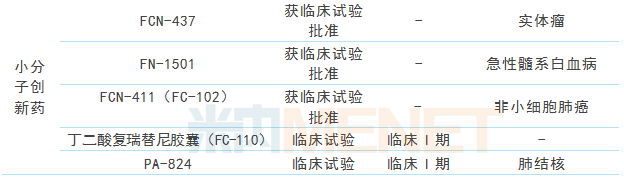
(来源:上市公司中报、米内网数据库)
据复星医药中报数据,报告期内,公司单抗研发进一步提速,截至报告期末,公司已有9个单抗产品(4个生物创新药)、13个适应症在国内获批临床,2个单抗产品、1个联合疗法于国内获临床试验申请受理。生物类似药中的曲妥珠单抗、阿达木单抗与贝伐珠单抗,生物创新药的重组人鼠嵌合抗CD20单克隆抗体注射液均已进入III期临床,有望陆续递交上市申请;利妥昔单抗申报生产并被纳入优先审评,有望2018年年底获批上市。
公司生物创新药抗PD-1单抗(HLX10)联合贝伐珠单抗生物类似药(HLX04)用于晚期实体瘤的治疗方案获国家药监局临床试验注册审评受理。这是国内首个获IND申请受理的国产单抗联合治疗方案,该方案不仅是公司联合治疗战略的进一步落地,更是国内联合治疗领域的重要里程碑事件。
综上,针对TNFα、VEGF、EGFR靶点的生物类似药、针对VEGFR2、EGFR靶点的生物创新药临床工作都在稳步推进,此外重组赖脯胰岛素、重组人胰岛素、重组甘精胰岛素三期临床进展顺利;在小分子创新药方面,FC-110(二酸复瑞替尼胶囊)、PA-824均已进入临床I期,FN-1501、FCN-437等均获批临床。
3个品种通过一致性评价,还有10个在路上
在一致性评价方面,公司紧跟时事政策,有序推进一致性评价工作。报告期内,公司苯磺酸氨氯地平片(商品名施力达)、草酸艾司西酞普兰片(商品名启程)及阿法骨化醇片(商品名立庆)顺利通过一致性评价。
表3:复星医药及子公司一致性评价通过品种情况
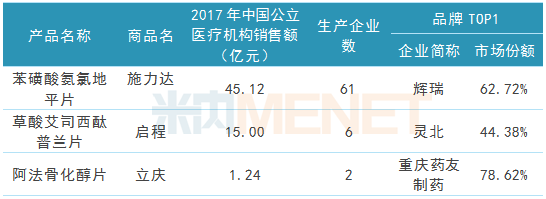
(来源:米内网数据库)
据米内网数据,目前拥有苯磺酸氨氯地平片生产批文的厂家多达61家,复星医药子公司是该品种首家通过一致性评价的企业,与后面通过一致性评价的扬子江上海海尼药业、华润赛科药业形成“三足鼎立”之势。从氨氯地平在2017年中国公立医疗机构终端竞争格局看,原研厂家辉瑞占据一半以上的市场份额,江苏黄河药业所占市场份额虽然较低,但有望通过后续政策红利进一步抢夺市场。
表4:复星医药及子公司一致性评价申请情况
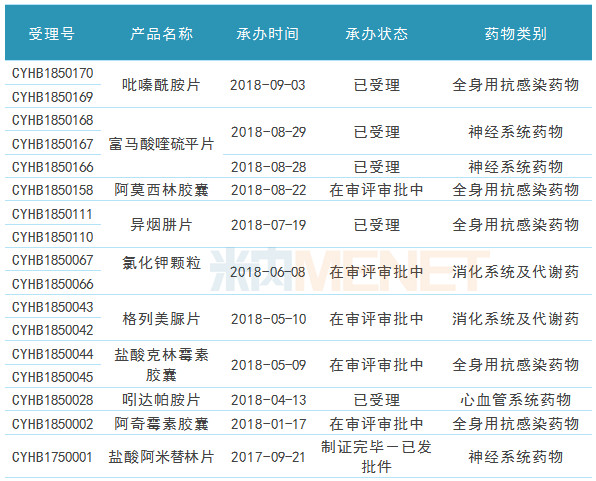
(来源:米内网MED中国药品审评数据库2.0,数据统计截至9月12日)
据米内网MED中国药品审评数据库2.0数据,截至2018年9月12日,复星医药及子公司一致性评价申请受理号共17个(不包括已通过一致性评价受理号,下同),涉及品种10个(不包括已通过一致性评价品种,下同),一致性评价申请情况仅次于齐鲁制药,其中在报告期内获得CDE承办的一致性评价申请受理号有9个,涉及品种6个。
来源:米内网数据库、上市公司中报及公告
声明:本网站部分文章和信息来源于互联网或原创作者/平台授权转载,不代表本订阅号赞同其观点和对其真实性负责,如有侵权请和我们联系处理,但若转载请务必注明原出处和作者。本平台刊载的各类文章重在分享,尊重原创,如有侵权请联系我们(010-67884870),我们将会在24小时之内删除。

